Последние новости
25. ноябрь 2011
Презентация продукта Овосан (Ovosan) впервые в России на выставке "Аптека 2011". Приходите к нам!
5. ноябрь 2011
Компания REDUCCIA s.r.o. ищет дистрибьюторов оригинальной биологически активной добавки Овосан (Ovosan) на российском рынке.
Эфирные фосфолипиды ПНАЭ в борьбе с опухолевыми клетками:
Предупреждение болезни и лечение метастазов
Выдержки из профессиональной публикации автора RNDr. Jindřich Kára DrSc. "Эфирные фосфолипиды ПНАЭ в борьбе с опухолевыми клетками: Предупреждение болезни и лечение метастазов", опубликованной AREKO в мае 2000 г. по случаю международного онкологического симпозиума, состоявшегося в Праге-Пругонице 5-6 мая 2000 г. под покровительством пражской «Лиги против рака».
2.1. Эфирные фосфолипиды с противоопухолевым эффектом
подавляют активность протеинкиназы С и вызывают селективное разрушение мембран опухолевых клеток.
Противоопухолевый эффект эфирных фосфолипидов был описан в различных публикациях (21-35). Чаще всего предметом изучения становился аналог синтетического лизофосфатидилхолина (лизолецитин), 1-0-октадецил-2-метокси-rac-глицеро-3-фосфохолин (ET-18-OCH3) (21-28). С помощью электронной микроскопии было доказано, что данное соединение селективным путем разрушает опухолевые клетки, а точнее мембраны таких клеток (24-26). Соединение ET-18-OCH3 (Эдельфозин) также повышает иммунологическую защиту организма, активирует противоопухолевую активность макрофагов, а также оказывает существенное влияние на опухолевые метастазы в экспериментальных моделях (21-24, 48). Другой аналог синтетического лизолецитина, тиоэфир 1-гексадецилмеркапто-2-метоксиметил-rac-глицеро-3-фосфохолин, (BM 41.440, илмофозин) обладает аналогичными противоопухолевыми эффектами (28). Кроме того, был подготовлен другой аналог синтетического фосфатидилхолина с противоопухолевым эффектом (27, 32). Клинические исследования данных препаратов, прежде всего эдельфозина и илмофозина, показали как их лечебный эффект (27, 28, 50), так и их вторичный токсический эффект, что ограничивает их клиническое использование.
Обнаружение нового алкил-фосфолипида с селективной противоопухолевой активностью (29), 1-0-алкил-2-ацил-sn-глицеро-3-фосфо-(N-ацил) этаноламин (ПНАЭ), который является естественным производным от фосфатидилэтаноламина, а также не оказывает никаких вторичных токсических эффектов на организм во время перорального и парентерального приема (29-35), открывает новые перспективы клинического использования этих нетоксичных эфирных фосфолипидов, особенно в предотвращении опухолевых метастазов в другие органы человеческого организма, в основном в печень (33, 35). В отличие от синтетических препаратов (ET-18-OCH3 и BM 41.440), которые являются смесью рацемических стереоизомеров, вещество ПНАЭ имеет естественную стереоконфигурацию, а также не содержит никаких неестественных радикалов в структуре своих молекул. Таким образом, ПНАЭ и его метаболиты не являются токсичными для организма, что является в высшей степени благоприятным при долговременном пероральном приеме и при предупреждении опухолевых метастазов у человека (33, 35). Разработка и подготовка полусинтетического эфирного фосфолипида ПНАЭ была уже описана (30, 34, 35), противоопухолевая активность ПНАЭ в естественных и искуственных условиях (30, 31), фармакокинетика и метаболизм в естественных условиях (33) были опубликованы (см. далее в разделе 5).
2.2. Индукция апоптоза в раковых клетках эфирными
фосфолипидами
Апоптоз является формой клеточной смерти, для которой характерны морфологические и биохимические изменения, такие как конденсация хроматина, расщепление ДНК, вызванное активацией эндонуклеаз (57, 58, 69). Стимулы, которые повышают плавное развитие клеточных мембран опухолевых клеток (например, гипертермия или 5% этанол) (70), или действующие эфирные фосфолипиды ET-18--OCH3 (57, 58), могут вызывать апоптическую гибель опухолевых клеток. Эфирные фосфолипиды вызывают апоптоз исключительно опухолевых клеток, т.е. не вызывают апоптоз нормальных физиологических клеток (58). В клетке существуют регуляционные гены, проявление которых может блокировать апоптическую гибель (например, митохондриальный протеин Bcl-2) (58, 71, 72). Вероятно, все противоопухолевые эфирные фосфолипиды вызывают апоптоз опухолевых клеток. На основании своих экспериментов M. Modolell и др. (58) пришли к выводу, что индукция апоптоза эфирными фосфолипидами ET-18--OCH3 включает в себя три главные стадии, описанные ниже:
- a) эфирые фосфолипиды соединяются с поверхностью клеточной мембраны;
- b) слияние эфирных фосфолипидов с клеткой;
- c) избавление от сигнализирующего механизма апоптоза, который может быть остановлен увеличенной концентрацией протеина Bcl-2.
Сутью вопроса являются параметры, которые могут быть разными в различных типах раковых клеток. Это также объясняет разную чувствительность раковых клеток к цитотоксическому действию эфирных фосфолипидов.
5.1. Натуральные, нетоксичные эфирные фосфолипиды ПНАЭ пласманил-(N-ацил)-этаноламин, их химическая структура, противоопухолевая активность в естественных и искуственных
условиях, а также механизм их действия.
Новые фосфолипиды были определены как 1-0-алкил-2-ацил-sn-глицеро-3-фосфо-(N-ацил)- этаноламин или плазманил-(N-ацил) этаноламин (ПНАЭ) (29).
Структурой основных молекулярных видов ПНАЭ является 1-0-октадецил-2-олеойл-sn-глицеро-3-фосфо-(N-пальмитоил) этаноламин (29, 30) (Рис. 1).
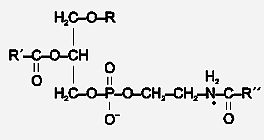
Рис.1: 1-0-алкил-2-ацил-sn-глицеро-3-фосфо-(N-ацил)-этаноламин или плазманил-(N-ацил)-этаноламин, ПНАЭ (Kára и др. 1986).
R-октадецил; R´-CO-олеойл; R´´-CO-пальмитоил
Предложенная нами структура ПНАЭ была также подтверждена профессором Dr. H. K. Mangold и др. (103), который подготовил ПНАЭ препараты с использованием синтетических алкил-эфиров глицерина и биотехнологии культур растительных клеток. С помощью этого специфического полусинтеза он подготовил производные с разной продолжительностью цепочки 1-0-алкил (1-0-тетрадецил, 1-0-гексадецил и 1-0-(Z)-9'-октадеценил) – ПНАЭ, которое имеет точно такую же противоопухолевую активность, как и наш полусинтетический алкил-фосфолипид ПНАЭ (103). Данные результаты опять указали на правильность химической структуры ПНАЭ (29, 30). Противоопухолевая активность чистого алкил-фосфолипида ПНАЭ была тестирована на тканевых культурах человеческих опухолевых клеток (HEp-2 a T24 lines) с помощью количественного измерения инкорпорации радиоактивного тимидина-3H в клеточное ДНК при росте концентрации ПНАЭ в микрограммах на 1 мл культурной среды (29).
Алкил-фосфолипиды ПНАЭ имеют селективный цитолитический эффект на человеческие опухолевые клетки HEp-2 и T24 lines (раковое образование в мочевом пузыре у человека) в тканевых культурах при концентрации ПНАЭ в 50 мкг /мл и подавляют пролиферацию опухолевых клеток даже при концентрации ПНАЭ в 2 мкг/мл, однако не подавляют биосинтез ДНК в нормальных клетках даже при концентрации в 50 раз больше в тканевых культурах человеческих фибробластов (29, 30), (Рис. 2). Данная поразительная селективная активность ПНАЭ только в опухолевых клетках свидетельствует об удивительном признаке ПНАЭ, а также о его нетоксичности для организма. Кроме того, рост человеческих клеток карциномы прямой кишки, устойчивый к фторурацилу у голых бестимусных мышей, значительно тормозится при дозе ПНАЭ в 4,5 мг на одну мышь в течение 21 дня (P. Poučková и др.) (100).
Alkyl-phospholipid PNAE has the selective cytolytic activity on human tumour cells of HEp-2 and T24 lines (human bladder carcinoma) in tissue cultures at the concentration of 50 µg of PNAE/ml and inhibits the proliferation of these tumour cells even at the concentration of 2 µg of PNAE/ml, but does not inhibit the biosynthesis of DNA in normal cells at 50 times higher concentration in the tissue culture of human fibroblasts (29, 30), (Fig. 2). This admirably selective activity of PNAE only against tumour cells indicates the great therapeutic index of PNAE and its nontoxicity for organism and also the growth of human rectum carcinoma cells resistant to fluorouracil in athymic nude mice was significantly inhibited at s. c. doses 4,5 mg of PNAE/mouse during 21 days (P. Poučková et al.) (100).
Точно так же, как и синтетические алкил-фосфолипиды, аналоги лизофосфатидил-холина (24-26), алкил-фосфолипид ПНАЭ приводит к селективному разрушению клеточных мембран человеческой опухолевой клетки (30, 35). В сотрудничестве с Dr. Z. Pelcbauer (Институт макромолекулярной химии, Чешская Академия Наук, г. Прага) и с помощью сканирующей электронной микроскопии, был доказан разрушительный эффект алкил-фосфолипида ПНАЭ на клеточные мембраны человеческих опухолевых клеток HEp-2 при условии 24-28-часовой инкубации этих клеток в тканевой культуре при 50мкг/мл ПНАЭ (30, 35), (см. Рис. 3, 4, 5).

Рис. 2: Селективный противоопухолевый эффект алкил-фосфолипида ПНАЭ на человеческие опухолевые клетки HEp-2 в культуре, без цитостатического эффекта на человеческие диплоидные фибробласты (LEP линия) при одинаковых условиях в параллельных экспериментах.
Клетки HEp-2, а также клетки LEP в течение 48 часов были инкубированы в культурных микро-пластинах в среде, содержащей указанные концентрации алкил-фосфолипида ПНАЭ. После ликвидации среды с ПНАЭ, в ДНК клеток HEp-2 и LEP был измерен тимидин-6-3H. Пролиферация опухолевых клеток HEp-2 была остановлена при концентрации ПНАЭ в 12,5 мкг/мл, в то время как рост нормальных LEP фибробластов не был остановлен даже при концентрации алкил-фосфолипида ПНАЭ в 10 раз больше (125 мкг/мл).
1 – инкорпорация тимидина -6-3H в ДНК опухолевых клеток HEp-2.
2 – инкорпорация тимидина -6-3H в ДНК LEP фибробластов.
Селективный эффект алкил-фосфолипида ПНАЭ на мембраны опухолевых клеток был также подтвержден Dr. A. Kotyk (Институт физиологии, Чешская Академия Наук, г. Прага), который вместе со своими коллегами экспериментальным путем доказал, что увеличенная проницаемость клеточной мембраны опухолевых клеток подвержена действию алкил-фосфолипида ПНАЭ. Диффузия 2-дезокси-D-глюкозы, именованной радиоизотопом 3H, через мембраны этих клеток значительно увеличилась по сравнению с контрольными опухолевыми клетками, которые не были инкубированы вместе с ПНАЭ. Проницаемость клеточных мембран нормальных физиологических клеток была на тех же условиях инкубации с ПНАЭ изменена (101, 102).
Важную роль в противоопухолевом и противометастазном действии ПНАЭ может также сыграть тормозящее действие ПНАЭ на энзиматическую активность протеинкиназы С, что было доказано методом эксперимента (39). Что касается влияния протеинкиназы С на метастатическую способность опухолевых клеток (11, 18, 19), долгосрочное действие алкил-фосфолипида ПНАЭ в естественных условиях на протеинкиназу С в опухолевых клетках может оказать существенное профилактическое действие в отношении распространения опухолевых клеток в организме, а также в отношении возникновения метастазов, прежде всего в печени, где во время повторного применения скапливается наибольшее количество ПНАЭ (33), (см Табл. 1).
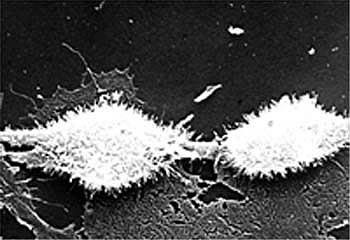
Рис. 3: Сканирующая электронная микрофотография человеческой опухолевой клетки HEp-2 в тканевой культуре. Микроворсины на поверхности клетки типичны для живой клетки.
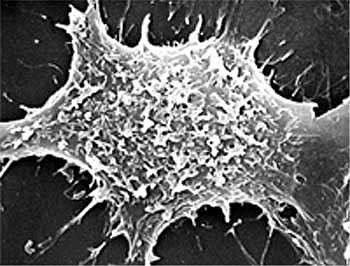
Рис. 4: Сканирующая электронная микрофотография клетки HEp-2, лечимой ПНАЭ (50мкг/мл) в течение 24 часов. Наблюдаются отверстия в клеточной мембране.
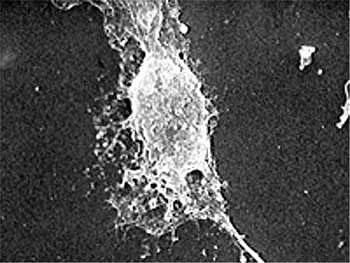
Рис. 5: Сканирующая электронная микрофотография клетки HEp-2, лечимой ПНАЭ (50мкг/мл) в течение 48 часов в культурной среде. Клеточная мембрана значительно повреждена, клетка погибла.
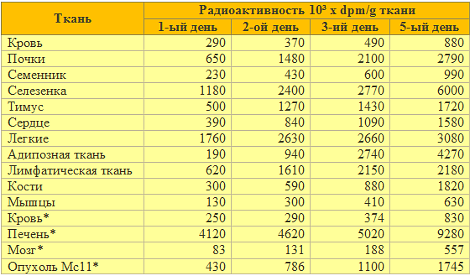
Табл. 1: Распространение радиоактивности 14C-ПНАЭ и 14C-поименованных метаболитов после повторных внутривенных инъекций BDF1 мышам-опухоленосителям (Mc11) (Kára J. и др., 33).
* Ежедневные внутривенные инъекции 0.9 мг 14C-ПНАЭ (25,6x106 dpm) вводили каждой из пяти BDF1 мышей, имеющей саркому Mc11. Радиоактивность в органах животных была определена спустя 24 часа после последней инъекции. Наибольшее скопление 14C-ПНАЭ и 14C-метаболитов после повторных внутривенных доз было обнаружено в печени мышей. Другие метаболические подробности, фармакокинетика, а также метаболизм 14C-ПНАЭ изложены в публикации автора J. Kára и др. (33).
5.3. Новая технология производства препарата Овосан, содержащего ПНАЭ.
С недавнего времени мы являемся разработчиками новой технологии производства препарата Овосан, содержащего большой процент эфирных фосфолипидов ПНАЭ. Препарат ОВОСАН в форме желатиновых капсул содержит суспензию яичных фосфолипидов с 30 % ПНАЭ и 60 % яичного лецитина (фосфатидилхолина) в растительном масле.
5.4. Возможность предотвращения метастаз в печень у пациентов после операции колоректальной аденокарциномы с помощью длительного перорального приема препарата, содержащего ПНАЭ.
Наша концепция профилактики метастазов с помощью длительного приема нетоксичных алкил-фосфолипидов ПНАЭ соответствует стратегии профилактики метастазов американского препарата карбоксиамидотриазола (CAI), предложенного E.C. Kohn и L.A. Liotta (95). В сравнении с CAI преимущество ПНАЭ и чешского препарата, содержащего ПНАЭ, заключается в полном отсутствии побочных токсических эффектов, которые проявляются в некоторых случаях длительного перорального приема синтетического препарата CAI (94). Высокая селективность опухолевого действия ПНАЭ является еще одним преимуществом данных натуральных эфирных фосфолипидов.
Предупреждение метастазов может дать несомненно лучшие перспективы для выживания пациентов, чем любое другое лечение метастазов, уже существующих в печени. Всегда лучше предупредить болезнь, чем лечить ее.
Ссылки:
11. BLOBE G.C., OBEID L.M., HANNUM Y.A.: Regulation of protein kinase C and role in cancer biology. Cancer and Metastases Reviews, 13, 411-431, 1994.
18. KORCZAK B., WHALE C., KERBEL R.S.: Possible involment of Ca2+ mobilization and protein kinase C activation in the induction of spontaneous metastasis by mouse mammary adenocarcinoma cells. Cancer Res.,49,2597-2602,
18b. GOPALAKRISHNA R., BARSKY S.H.: Tumor promoter-induced membrane bound protein kinase C regulates hematogenous metastasis. Proc.Natl.Acad.Sci. USA, 85, 612-616, 1988.
19. DUMONT J.A., JONES W.D., BITONTI A.J.: Inhibition of experimental metastasis and cell adhesion of B16F1 melanoma cells by inhibitors of protein kinase C. Cancer Res., 52, 1195-1200, 1992.
21. BERDEL W.E., BAUSERT W.R.E., FINK U., RSTETTER J., MUNDER P.G.: Anti-tumor action of alkyl-lysophospholipids. Anticancer Research, 1, 345-352, 1981.
22. BERDEL W.E. and MUNDER P.G.: Antineoplastic actions of ether lipids related to platelet-activating factor. (in: Platelet-activating factor and related lipid mediators, Editor F. Snyder, Plenum Publishing Corporation, pp.449-467, 1987.
23. BERDER W.E., ANDREESEN R., MURDER P.G.: Synthetic alkyl-phospholipid analogs: A new class of antitumor agents. (in: Phospholipids and Cellular Regulation, editor J.F. Kuo, CRC Press Inc., pp. 42-73, 1985.
24. ANDREESEN R.: Ether-phospholipids in the therapy of cancer. Progress in Biochemical Pharmacology, 22, 118-131, 1988, Karger, Basel.
25. NOSEDA A., WHITE J.G., GODWIN P.I., JEROME W.G. and MODEST E.J.: Membrane damage in leukemic cells induced by ether and ester lipids: An electron microscopic study. Experimental and Molecular Pathology, 50, 69-83, 1989.
26. BERDEL W.E., GREINER E., FINK U., ZENKER K.S., STAVROU D., TRAPPE A., FAHLBUSCH R., REICHERT A., RASTETTER J.: Cytotoxic effects of alkyl-lysophospholipids in human brain tumor cells. Oncology, 41, 140-145, 1984.
27. BERDEL W.E.: Membrane - interactive lipids as experimental anticancer agents. Brit. J. Cancer, 64, 208-211, 1991.
28. HERRMANN D.B.J., NEUMANN H.A., BERDEL W.E., HEIM M.E., FROM M., BOERNER D., BICKER U.: Phase I trial of the thioether phospholipid analogue BM 41,440 in cancer patients. Lipids, 22,962-966, 1987.
29. KÁRA J., BOROVIČKA M., LIEBL V., SMOLÍKOVÁ J., UBIK K.: A novel nontoxic alkyl-phospholipid with selective antitumor activity, plasmanyl-(N-acyl)ethanolamine (PNAE), isolated from degenerating chick embryo tissues and from an anticancer biopreparation cACPL. Neoplasma, 33, 187-205, 1986.
30. KÁRA J., LIEBL V., PELCBAUER Z.: Natural and semisynthetic ether phospholipids with selective antitumor activity; their chemical structure and mechanism of action leading to tumor cell membrane destruction. (in: Highlights of Modern Biochemistry, Prague, Czechoslovakia, July 10-15, 1988) vol.2, pp.1459-1474 1989, Editors: A. KOTYK, J. ŠKODA, V.PAČES, V.KOSTKA, VSP Utrecht, The Netherlands, 1989.
31. KÁRA J., KONOVALOVA A.L., KRASNOVA M.A., LIEBL V., BEJŠOVCOVÁ L.: New tumoricidal semisynthetic ether phospholipid, plasmanyl-(N-acyl)ethanolamine (PNAEs) and enhancement of its tumoricidal activity by calcium ions. Neoplasma, 40, 213-217, 1993.
32.LAZENBY C.M., THOMPSON M.G., HICKMAN J.A.: Elevation of leukemic cell intracellular calcium by the ether lipid SRI 62-834. Cancer Res., 50, 3327-3330, 1990.
33.KÁRA J., ZIMAKOVA N.I., SEREBRYAKOVA E.A., DĚDKOVÁ V., ZOLOTARYOV A.F.: Pharmacokonetics and metabolism of a new antitumor semisynthetic ether phospholipid, 14C-labeled plasmanyl-(N-acyl)ethanolamine in mice bearing sarcoma Mc11. J. Cancer Res. Clin. Oncol:, 120, 662-667, 1994.
34.KÁRA J., LIEBL V., DĚDKOVÁ V., BEJŠOVCOVÁ L.: Způsob semisyntetické přípravy alkyl-fosfoplipidu se selektivním protinádorovým účinkem. Čs. patent č. 275396, 1991.
35.KÁRA J.: Ether-fosfolipidy v onkologii. Chemické listy, 87, 58-63, 1993.
39.MIKHAEVICH I.S., GERASIMOVA G.K., KÁRA J.: Inhibition of protein kinase C by semisynthetic phospholipid plasmanyl-(N-acyl)ethanolamine, a nontoxic antitumor preparation. Biochemistry International, 23, 215-220, 1991.
50.KHANAYKAR B., ULBRICH F., GATZEMEIER U., MEYER-SCHEICKERATH E., LORENZ J., SCHREML W., BRUGGER R., SCHICK H.D., von PAWEL J., NORDSTROM R., DRINGS P.: Treatment of non-smoll cell lung cancer with alkyl-phospholipid Edelfosine. Contrib. Oncol., 37, 224-235, 1989.
57.DIOMEDE L., COLOTTA F., PIOVANI B., RE F., MODEST E.J., and SALMONA M.: Induction of apoptosis in human leukemic cells by the ether lipid 1-octadecyl-2-methyl--rac-glycero-3-phosphocholine. A possible basis for its selective action. Int.J.Cancer, 53, 124-130, 1993.
58.MOLLINEDO F., FERNÁNDEZ-LUNA J.L., GAJATE C., MARTIN-MARTÍN B., BENITO A., MERTINEZ-DALMAU R., MODOLELL M.: Selective induction of apoptosis in cancer cells by the lipid ET-18-OCH3 (Edelfosine): Molecular structure requirements, cellular uptake, and protection by Bc1-2 and Bc1-XL. Cancer Res., 57, 1320-1328, 1997.
69.WYLLIE A.H.: Glucocorticoid-induced thymocyte apoptosis is associated with endogenous endonuclease activation. Nature, 284, 555-556, 1980.
100.POUČKOVÁ P., ZADINOVÁ M., NAVRÁTIL L., BLEHOVÁ Z.: Vliv plasmanyl-(N--acyl)ethanolaminu na růst karcinomu recta xenotransplantovaného na athymické nu/nu myši. Časopis lékařů českých, 126, 1569-1571, 1987.
101.KOTYK A., KÁRA J., BAUDYŠOVÁ M., KNOTKOVÁ A., DRAHOTA Z.: Effect of alkyl--phospholipids on mammalian cell permeability. v knize: Molecular Aspects of Human Diseases, (Gorrod J.W., Albamo O., Papa S editors), vol.1., pp. 41-43, Ellis Horwood Ltd., Chichestr, 1989.
102.KOTYK A., KÁRA J., LIEBL V., DRAHOTA Z.: Internat Conf. on Perspectives in Molecular Approaches to Human Diseases, Bari, Italy,1987.
103. APTE S.S., WEBER N., MANGOLD H.K.: Biologically active ether lipids. Biotransformation of rac-1(3)-0-alkylglycerols in cell suspension cultures of rape and semisynthesis of 1-0-alkyl-2-palmitoyl-sn-glycero-3-phospho-(N-palmitoyl) ethanolamines, potent antitumor agents. FEBS Letters, 265, 104-105, 1990.